Mercurio --> Tristán / Evelyn / Mariana / Vargas / Zuñiga
Potasio --> Jeny Medina / Ramires / Coque / Marcelo / Ana Karen
Plomo --> Monica / Monica / De la Torre / Mike Salazar
Helio --> Cordero / Siller / Guille / Aurelio / Fercho
Titanio --> Arciva / Caro / Ericka / Luis G
Arsénico --> Ayala / Paloma / Grecia / Valeria
Litio --> Rosalba / Sergio / Paola / Braulio
Cloro --> Christopher / Ilean / Javier / Uriel / Camporredondo
Renio --> Juan Pablo / Karen /
Fósforo --> Wendy / Lesly / Kenia / Alejandra / Melanie
Yodo --> Irlanda / Cristina / Gema / Félix / Maldonado
Silicio --> Limón / SanMike / Lara / Salma
Cromo --> Mayela / Recinas / Claudia / AnnaPaola / Solís
Estaño --> Néstor / Valeria / Fer DLeon / Melanie
Azufre --> Rosel / Macías / Roger / JP
Uranio --> Gabo / Molina / Luisa / Lore
Platino --> Aceves
La Rúbrica la pueden descargar de aquí.
lunes, 11 de noviembre de 2013
domingo, 20 de octubre de 2013
Historia de los Modelos Atómicos
Aquí podemos observar un resumen de los Modelos Atómicos.
http://aprendequimica.blogspot.es/1240683000/historia-modelos-at-micos/
El modelo atómico actual que se le asigna a Schrödinger lo podemos ver aquí:
http://aprendequimica.blogspot.es/1240682460/modelo-de-schr-dinger/
http://aprendequimica.blogspot.es/1240683000/historia-modelos-at-micos/
El modelo atómico actual que se le asigna a Schrödinger lo podemos ver aquí:
http://aprendequimica.blogspot.es/1240682460/modelo-de-schr-dinger/
martes, 8 de octubre de 2013
domingo, 6 de octubre de 2013
viernes, 23 de agosto de 2013
Introducción a la Química Analítica
Jóvenes:
Les dejo las presentaciones que abarcan esta primera unidad.
Les recuerdo que esta información la pueden estudiar directamente de el sitio http://apuntescientificos.org/qa01.html
Saludos.
viernes, 2 de agosto de 2013
Lípidos y Carbohidratos
Estudien los ácidos grasos, y de los lípidos saponificables, estudien los triacilglicéridos o llamados también triglicéridos. De todos ellos estudien sus características y su estructura.
Lípidos from jujosansan
De los carbohidratos estudien su estructura y función, y los principales polisacáridos: Almidón, glucógeno, celulosa y quitina.
De los carbohidratos estudien su estructura y función, y los principales polisacáridos: Almidón, glucógeno, celulosa y quitina.
martes, 30 de julio de 2013
martes, 23 de julio de 2013
lunes, 22 de julio de 2013
lunes, 8 de julio de 2013
martes, 2 de julio de 2013
Procesos de Óxido-Reducción: Electroquímica
lunes, 24 de junio de 2013
jueves, 20 de junio de 2013
Biología 2: Proyecto "Ciencias ayudando a la vida"
Los equipos:
Equipo 1: Gerardo Aceves, Carlos Mtz, Héctor Orozco, Xavier Flores, Osmar Dávila
TEMA: ¿Puedo comer alimentos transgénicos?
Equipo 2: Kevin Alejos, Mariel Ramírez, Bernardo Torres, Carlos Álvarez, Fátima Sánchez
TEMA: Cómo generar una vacuna para la Influenza AH1N1
Equipo 3: Pamela Medina, Edimer Peralta, Alejandro Quiroz, Fernanda Ayala, Roberto Santana
TEMA: ¿Cómo ayuda la terapia génica?
Equipo 4: Miguel Borjas, Daniel Mota, Carlos Quintanilla, Cecilia Salazar, Emiliano García
TEMA: Cómo favorecer la producción de huevo
Equipo 5: Alejandra Álvarez, Karen González, Alejandro Rueda, Stephanie Romero, Juan Zavala
TEMA: ¿Cómo puedo prevenir genéticamente el cáncer?
El tema se va a desarrollar a través de una exposición y se van a evaluar 5 aspectos, que se describen en la rúbrica que les dejo en el siguiente enlace: Rúbrica de Proyecto.
La tarea para el lunes es traer definido qué elementos visuales presentarán en la exhibición (2 mínimo); y cuál será el producto que van a entregar: Diagrama. Maqueta o Video. Ustedes como equipo pueden decidir qué es lo que más conviene hacer dependiendo del tema que están tratando. Pueden ayudarse de muestras reales.
La tarea para el martes es traer la investigación documental, que es uno de los 5 aspectos a evaluar, en forma electrónica, a mi correo.
FECHA DE LA EXPOSICIÓN: 2 al 4 de Julio.
Dudas a mi correo, o por inbox o tweet
arturo.caballero.rdz@gmail.com
https://www.facebook.com/messages/arturo.caballero.rdz
http://twitter.com/arturocaballero
Equipo 1: Gerardo Aceves, Carlos Mtz, Héctor Orozco, Xavier Flores, Osmar Dávila
TEMA: ¿Puedo comer alimentos transgénicos?
Equipo 2: Kevin Alejos, Mariel Ramírez, Bernardo Torres, Carlos Álvarez, Fátima Sánchez
TEMA: Cómo generar una vacuna para la Influenza AH1N1
Equipo 3: Pamela Medina, Edimer Peralta, Alejandro Quiroz, Fernanda Ayala, Roberto Santana
TEMA: ¿Cómo ayuda la terapia génica?
Equipo 4: Miguel Borjas, Daniel Mota, Carlos Quintanilla, Cecilia Salazar, Emiliano García
TEMA: Cómo favorecer la producción de huevo
Equipo 5: Alejandra Álvarez, Karen González, Alejandro Rueda, Stephanie Romero, Juan Zavala
TEMA: ¿Cómo puedo prevenir genéticamente el cáncer?
El tema se va a desarrollar a través de una exposición y se van a evaluar 5 aspectos, que se describen en la rúbrica que les dejo en el siguiente enlace: Rúbrica de Proyecto.
La tarea para el lunes es traer definido qué elementos visuales presentarán en la exhibición (2 mínimo); y cuál será el producto que van a entregar: Diagrama. Maqueta o Video. Ustedes como equipo pueden decidir qué es lo que más conviene hacer dependiendo del tema que están tratando. Pueden ayudarse de muestras reales.
La tarea para el martes es traer la investigación documental, que es uno de los 5 aspectos a evaluar, en forma electrónica, a mi correo.
FECHA DE LA EXPOSICIÓN: 2 al 4 de Julio.
Dudas a mi correo, o por inbox o tweet
arturo.caballero.rdz@gmail.com
https://www.facebook.com/messages/arturo.caballero.rdz
http://twitter.com/arturocaballero
Biología 1: Proyecto "Ciencias ayudando a la vida"
Los equipos:
Equipo 1: Karla Rubí, Paula Adriana, Fernanda Cantú, Gaby Quintero,
TEMA: ¿Cómo puedo producir más y mejor vino/cerveza?
Centren su tema en las levaduras modificadas.
Equipo 2: Alejandra Silva, Ricardo De la Torre, Ruth LV, Israel Ortiz, Enrique Gámez
TEMA: ¿Cómo puedo crear insecticidas ecológicos?
Centren su tema en los biopesticidas.
Equipo 3: Lorena Esquivel, Ale y Fer Montemayor, AnaElisa Reyes, Ninfa Muraira
TEMA: Cómo solucionar la diabetes.
Equipo 4: Luis Roberto, Jesús Daniel, Denisse Mendoza, Fernando Peña, Carlos Islas
TEMA: Cómo remediar un derrame de petróleo
Equipo 5: Julio Silva, Samuel Martínez, Adolfo Villarreal, Román Sánchez, Carlos Gaytán
TEMA: Cómo reconocer a un delincuente con sus huellas
El tema se va a desarrollar a través de una exposición y se van a evaluar 5 aspectos, que se describen en la rúbrica que les dejo en el siguiente enlace: Rúbrica de Proyecto.
La tarea para el lunes es traer definido qué elementos visuales presentarán en la exhibición (2 mínimo); y cuál será el producto que van a entregar: Diagrama. Maqueta o Video. Ustedes como equipo pueden decidir qué es lo que más conviene hacer dependiendo del tema que están tratando. Pueden ayudarse de muestras reales.
La tarea para el martes es traer la investigación documental, que es uno de los 5 aspectos a evaluar, en forma electrónica, a mi correo.
FECHA DE LA EXPOSICIÓN: 2 al 4 de Julio.
Dudas a mi correo, o por inbox o tweet
arturo.caballero.rdz@gmail.com
https://www.facebook.com/messages/arturo.caballero.rdz
http://twitter.com/arturocaballero
Equipo 1: Karla Rubí, Paula Adriana, Fernanda Cantú, Gaby Quintero,
TEMA: ¿Cómo puedo producir más y mejor vino/cerveza?
Centren su tema en las levaduras modificadas.
Equipo 2: Alejandra Silva, Ricardo De la Torre, Ruth LV, Israel Ortiz, Enrique Gámez
TEMA: ¿Cómo puedo crear insecticidas ecológicos?
Centren su tema en los biopesticidas.
Equipo 3: Lorena Esquivel, Ale y Fer Montemayor, AnaElisa Reyes, Ninfa Muraira
TEMA: Cómo solucionar la diabetes.
Equipo 4: Luis Roberto, Jesús Daniel, Denisse Mendoza, Fernando Peña, Carlos Islas
TEMA: Cómo remediar un derrame de petróleo
Equipo 5: Julio Silva, Samuel Martínez, Adolfo Villarreal, Román Sánchez, Carlos Gaytán
TEMA: Cómo reconocer a un delincuente con sus huellas
El tema se va a desarrollar a través de una exposición y se van a evaluar 5 aspectos, que se describen en la rúbrica que les dejo en el siguiente enlace: Rúbrica de Proyecto.
La tarea para el lunes es traer definido qué elementos visuales presentarán en la exhibición (2 mínimo); y cuál será el producto que van a entregar: Diagrama. Maqueta o Video. Ustedes como equipo pueden decidir qué es lo que más conviene hacer dependiendo del tema que están tratando. Pueden ayudarse de muestras reales.
La tarea para el martes es traer la investigación documental, que es uno de los 5 aspectos a evaluar, en forma electrónica, a mi correo.
FECHA DE LA EXPOSICIÓN: 2 al 4 de Julio.
Dudas a mi correo, o por inbox o tweet
arturo.caballero.rdz@gmail.com
https://www.facebook.com/messages/arturo.caballero.rdz
http://twitter.com/arturocaballero
Encontrando el origen de la vida
Aquí encontramos un excelente video donde vemos a los Aminoácidos como las sustancias que se logran sintetizar a partir de los experimentos de Miller con sustancias inorgánicas, aunque aún no son la vida misma, les da a los científicos la esperanza de formar la vida, desde cero.
lunes, 10 de junio de 2013
Ácidos y Bases - Teoría
El contenido teórico que se vió para este Parcial abarca de la página 612 a la 633 de este libro.
Lo pueden descargar de este enlace.
Mucho éxito.
Lo pueden descargar de este enlace.
Mucho éxito.
sábado, 8 de junio de 2013
El Cáncer
El cáncer es una enfermedad originada por el descontrol en el ciclo celular, donde se presenta una división indefinida de la célula, sin control.
Las mutaciones relacionadas con el cáncer se deben por los oncogenes (gen maligno), los cuales están relacionados con el control de la división celular. Estos oncogenes se ha sugerido que se formaron por unos virus llamados retrovirus.
Actualmente las formas más reconocidas para tratar el cáncer son la cirugía, la radiación (radioterapia) y la quimioterapia.
Las mujeres representan un sector de la población muy atacado por el cáncer de mama y el cáncer cérvico uterino. Los principales métodos para detectar el cáncer, son el ultrasonido de senos y las mamografías. Adicional a ello se utiliza la tinción de Papanicolaou para la detección de células cancerígenas en la vagina.
Las mutaciones relacionadas con el cáncer se deben por los oncogenes (gen maligno), los cuales están relacionados con el control de la división celular. Estos oncogenes se ha sugerido que se formaron por unos virus llamados retrovirus.
Actualmente las formas más reconocidas para tratar el cáncer son la cirugía, la radiación (radioterapia) y la quimioterapia.
Las mujeres representan un sector de la población muy atacado por el cáncer de mama y el cáncer cérvico uterino. Los principales métodos para detectar el cáncer, son el ultrasonido de senos y las mamografías. Adicional a ello se utiliza la tinción de Papanicolaou para la detección de células cancerígenas en la vagina.
miércoles, 5 de junio de 2013
La herencia biológica. El trabajo de Mendel.
1a Ley de Mendel -- Uniformidad
Si se cruzan dos razas puras para un determinado carácter, los descendientes de la primera generación serán todos iguales entre sí fenotípica y genotípicamente, e iguales fenotípicamente a uno de los progenitores (de genotipo dominante), independientemente de la dirección del cruzamiento.
AA + aa = Aa, Aa, Aa, Aa.
2a Ley de Mendel -- Segregación
Para cada característica, un organismo hereda dos alelos, uno de cada pariente. Esto significa que en las células somáticas, un alelo proviene de la madre y otro del padre.
El Método Científico
El método científico es la manera correcta de abordar y tratar un asunto o problema para llegar a obtener un nuevo conocimiento sobre dicho asunto. Nos indica el camino correcto para llevar a cabo una investigación científica.
Definición del Problema:
Establecer cuál es el problema o suceso que se piensa resolver.
Observaciones:
Recabar toda la información posible del problema estudiado para poder analizarla y empezar a deducir.
Hipótesis:
Emitir una posible explicación al problema, usando las observaciones y la lógica para entender porqué sucede.
Experimentación:
Se confecciona un experimento que logre poner a prueba la hipótesis, controlando todas las variables y dejando una sola variable efectivamente variable para comprobar si es la causa del problema.
Teoría o Ley:
Si la experimentación confirmó, la hipótesis, ésta pasa a ser una teoría. Se corren diferentes experimentos para comprobar efectivamente que esa es la causa del problema y validar la teoría. Si en diferentes lugares, diferentes científicos han logrado repetir el experimento con los mismos resultados confirmatorios en diferentes momentos, podemos decir que estamos ante una ley.
Características de los Seres Vivos
Estructura
Todos los seres vivos poseen una estructura organizada, formada con una parte de los elementos químicos que existen en la naturaleza, a los que se les da el nombre de bioelementos.
Desde la estructura de un organismo pluricelular, hasta sus células individuales, los seres vivos mantienen una estructura en ellos mismos que se respeta para cada individuo de dicha especie.
Organización
Los seres vivos presentan una organización a diferentes niveles. Cada nivel está organizado para dar origen a otro elemento de un nivel más grande. Esto se hace visible en la escala llamada "Los Niveles de Organización Biológica".
Metabolismo
Metabolismo es la suma de todas las funciones que llevan a cabo los seres vivos. Ejemplo de ello es la respiración y la digestión. Dichas funciones se realizan con base a funciones químicas reguladas por catalizadores químicos, llamados enzimas.
Anabolismo es la construcción de nueva materia viva a través de la unión de moléculas sencillas. Catabolismo es la descomposición de moléculas complejas en algunas más sencillas típicamente para aprovechar la energía que contienen en sus enlaces.
Homeostasis
Es la capacidad de los seres vivos de mantener constante, hasta cierto límite, el equilibrio biológico de su ambiente interno, en forma independiente a las variantes externas e internas por medio de sus mecanismos homeostáticos.
Ejemplo de estos mecanismos es la sudoración, para regular la temperatura cuando el cuerpo se calienta, y los escalofríos que ocurren en los músculos para generar movimiento y calor, cuando el cuerpo siente mucho frío.
El sistema endocrino cumple aquí una labor de regulación del ambiente interno, en donde la sudoración, la orina y las heces sacan del cuerpo toxinas y desechos que el cuerpo no necesita.
Crecimiento
La nutrición es una forma de adquirir nutrientes y energía para que un ser vivo pueda aumentar progresivamente de tamaño hasta alcanzar los límites característicos de su especie.
Reproducción
Los seres vivos se continúan o perpetúan su especie a través de dos tipos de reproducciones: Sexual y Asexual. En la reproducción Sexual intervienen células reproductoras de 2 progenitores. En la Asexual sólo existe un progenitor.
Evolución
Los seres vivos son capaces de adaptarse a nuevas condiciones y con el paso del tiempo esos cambios se registran en su código genético, logrando que el organismo con el paso del tiempo evolucione de manera que conserve los cambios que mejor se adaptaron a su ambiente.
Todos los seres vivos poseen una estructura organizada, formada con una parte de los elementos químicos que existen en la naturaleza, a los que se les da el nombre de bioelementos.
Desde la estructura de un organismo pluricelular, hasta sus células individuales, los seres vivos mantienen una estructura en ellos mismos que se respeta para cada individuo de dicha especie.
Organización
Los seres vivos presentan una organización a diferentes niveles. Cada nivel está organizado para dar origen a otro elemento de un nivel más grande. Esto se hace visible en la escala llamada "Los Niveles de Organización Biológica".
Metabolismo
Metabolismo es la suma de todas las funciones que llevan a cabo los seres vivos. Ejemplo de ello es la respiración y la digestión. Dichas funciones se realizan con base a funciones químicas reguladas por catalizadores químicos, llamados enzimas.
Anabolismo es la construcción de nueva materia viva a través de la unión de moléculas sencillas. Catabolismo es la descomposición de moléculas complejas en algunas más sencillas típicamente para aprovechar la energía que contienen en sus enlaces.
Homeostasis
Es la capacidad de los seres vivos de mantener constante, hasta cierto límite, el equilibrio biológico de su ambiente interno, en forma independiente a las variantes externas e internas por medio de sus mecanismos homeostáticos.
Ejemplo de estos mecanismos es la sudoración, para regular la temperatura cuando el cuerpo se calienta, y los escalofríos que ocurren en los músculos para generar movimiento y calor, cuando el cuerpo siente mucho frío.
El sistema endocrino cumple aquí una labor de regulación del ambiente interno, en donde la sudoración, la orina y las heces sacan del cuerpo toxinas y desechos que el cuerpo no necesita.
Crecimiento
La nutrición es una forma de adquirir nutrientes y energía para que un ser vivo pueda aumentar progresivamente de tamaño hasta alcanzar los límites característicos de su especie.
Reproducción
Los seres vivos se continúan o perpetúan su especie a través de dos tipos de reproducciones: Sexual y Asexual. En la reproducción Sexual intervienen células reproductoras de 2 progenitores. En la Asexual sólo existe un progenitor.
Evolución
Los seres vivos son capaces de adaptarse a nuevas condiciones y con el paso del tiempo esos cambios se registran en su código genético, logrando que el organismo con el paso del tiempo evolucione de manera que conserve los cambios que mejor se adaptaron a su ambiente.
Ramas de la Biología
Genética: Estudia la herencia biológica.
Evolución: Estudia el origen y los cambios en los organismos.
Fisiología: Estudia las funciones de los seres vivos.
Anatomía: Estudia la descripción de órganos, aparatos y sistemas.
Histología: Estudia los tejidos.
Citología: Estudia las células.
Embriología: Estudia el desarrollo de embriones a partir del huevo.
Paleontología: Estudia los organismos y sus huellas (fósiles).
Ecología: Estudia la interrelación de los seres vivos con el medio ambiente.
Taxonomía: Estudia la clasificación de los seres vivos.
Etología: Estudia el carácter y comportamiento.
Evolución: Estudia el origen y los cambios en los organismos.
Fisiología: Estudia las funciones de los seres vivos.
Anatomía: Estudia la descripción de órganos, aparatos y sistemas.
Histología: Estudia los tejidos.
Citología: Estudia las células.
Embriología: Estudia el desarrollo de embriones a partir del huevo.
Paleontología: Estudia los organismos y sus huellas (fósiles).
Ecología: Estudia la interrelación de los seres vivos con el medio ambiente.
Taxonomía: Estudia la clasificación de los seres vivos.
Etología: Estudia el carácter y comportamiento.
lunes, 27 de mayo de 2013
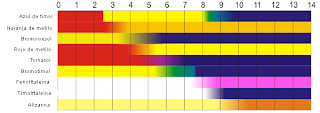
Cromatografía | 3 ejemplos
Cromatografía en Capa Fina
Cromatografía en Columna (en bureta)
Cromatógrafo de Gases
Cromatografía en Columna (en bureta)
Cromatógrafo de Gases
viernes, 24 de mayo de 2013
jueves, 23 de mayo de 2013
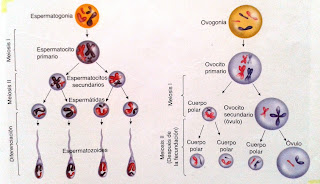
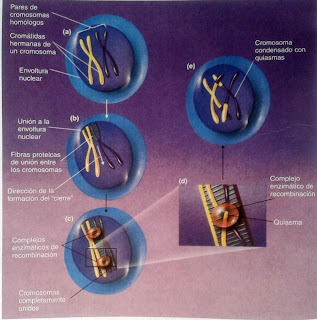
Profase I: La fase distintiva de la Meiosis
Esta parte de la Meiosis es la más importante ya que se da el entrecruzamiento de cromosomas homólogos en donde éstos intercambian sectores.
lunes, 20 de mayo de 2013
domingo, 12 de mayo de 2013
miércoles, 8 de mayo de 2013
Definición de Equivalente químico
Cuando las sustancias químicas reaccionan para formar compuestos, en esencia lo que sucede es que una de las moléculas (o átomos) de uno de ellos reacciona con una o mas moléculas (o átomos) del otro para generar la nueva sustancia, de forma que siempre el cociente entre los números de las moléculas (o átomos) reaccionantes de uno u otro compuesto es un número entero y nunca fraccionario, lo que se conoce como ley de proporciones definidas. Por ejemplo, si el ácido clorhídrico (HCl) reacciona con la sosa cáustica (NaOH) según la reacción siguiente:
Una molécula de ácido habrá reaccionado con otra de la base (sosa) para formar dos nuevas moléculas, una de agua (H2O) y otra de cloruro de sodio (NaCl), en este caso la relación entre el número de moléculas que han reaccionado, no importa la cantidad total de estas de cada compuesto será 1:1.
Si analizamos ahora para el caso de ácido sulfúrico (H2SO4) reaccionando con la sosa cáustica tendremos:
Observe que ahora una molécula de ácido reacciona con dos de sosa y por tanto la relación moléculas de ácido/moléculas de sosa es de 1:2.
Esta cuestión de que la relación entre los números de moléculas reaccionantes es siempre un número entero es muy útil para determinar las cantidades totales de moléculas que deben juntarse en una reacción para lograr el, o los productos finales sin que sobren moléculas de ninguno de los dos compuestos originales, lo que se conoce como reacción estequeométrica.
Ahora, una molécula es una entidad muy pequeña, y su conteo físico resulta literalmente imposible en la práctica como para establecer la reacción estequeométrica contándolas, ya que cuando se ponen a reaccionar dos sustancias, aunque las cantidades sean pequeñas, el número de moléculas presentes es muy elevado. Por este motivo en lugar de contar las moléculas se usa una unidad mucho mas grande conocida como mol. Un mol de cualquier sustancia tiene siempre una misma cantidad de moléculas 6.023 x 1023 (número de Avogadro), de forma que resultarán iguales en valor, la relación entre los números de moléculas reaccionantes y el número de moles reaccionantes de las sustancias.
El mol queda definido como el peso molecular expresado en gramos, de esta forma un mol de agua, cuyo peso molecular es 18, pesa 18 gramos y a la vez esto significa que 18 gramos de agua tienen 6.023 x 1023 moléculas. Similarmente, el peso molecular del fenobarbital que es 232.2, significa que 232.2 gramos de fenobarbital (un mol) tienen 6.023 x 1023 moléculas.
La utilización del mol como unidad para la determinación de la estequiometría química es sumamente práctica ya que sustituye el impracticable conteo de las moléculas, por una unidad fácilmente medible como peso. Refiriéndonos a las dos reacciones de arriba, se puede decir entonces que un mol de ácido clorhídrico reacciona exactamente (de forma estequeométrica) con un mol de hidróxido de sodio (sosa cáustica), mientras que se necesitan dos moles de la sosa para reaccionar con un mol de ácido sulfúrico.
El equivalente químico de una sustancia, a veces llamado la fuerza de reacción, es el número de iones univalentes (con valencia 1) necesarios para reaccionar con cada molécula de la sustancia. El ácido clorhídrico tiene equivalente 1 por mol debido a que 1 mol del ion univalente OH- reacciona exactamente con 1 mol de H+ del HCl para formar agua, o un mol de Na+ reaccionaría con el Cl- del ácido clorhídrico para formar cloruro de sodio. Por su parte el ácido sulfúrico (H2SO4) contiene 2 equivalentes por mol porque se requieren 2 moles de OH- para actuar sobre 1 mol de ácido sulfúrico o, de igual, forma se necesitan 2 moles de Na+ para reaccionar exactamente con el ion (SO4)+2.
El compuesto Al2(SO4)3 tiene equivalente 6 porque en solución acuosa se obtienen dos iones Al+3 capaces de reaccionar con 6 iones monovalentes tal como Cl- , o el triple ion sulfato (3SO4-2) también reacciona con 6 iones univalentes como el Cl-.
El término equivalente químico tiene cierta ambigüedad para el caso de electrolitos con iones de valencia variable como los fosfatos o carbonatos, en los cuales la sustancia puede tener diferentes grados de equivalencia en dependencia del pH de la solución. Por ejemplo el Na2HPO4 (fosfato disódico) tiene 2 equivalentes/mol y predomina en soluciones de pH alto, mientras el NaH2PO4 (fosfato monosódico) con equivalente/mol de 1 predomina en las soluciones con pH bajo.
P.E. = Peso molecular ó Masa molar / No. Equivalentes por Peso molecular
Tomado de http://www.sabelotodo.org/quimica/equivalente.html
| HCl | + | NaOH | ===> | NaCl | + | H2O |
Una molécula de ácido habrá reaccionado con otra de la base (sosa) para formar dos nuevas moléculas, una de agua (H2O) y otra de cloruro de sodio (NaCl), en este caso la relación entre el número de moléculas que han reaccionado, no importa la cantidad total de estas de cada compuesto será 1:1.
Si analizamos ahora para el caso de ácido sulfúrico (H2SO4) reaccionando con la sosa cáustica tendremos:
| H2SO4 | + | 2NaOH | ===> | Na2SO4 | + | 2H2O |
Observe que ahora una molécula de ácido reacciona con dos de sosa y por tanto la relación moléculas de ácido/moléculas de sosa es de 1:2.
Esta cuestión de que la relación entre los números de moléculas reaccionantes es siempre un número entero es muy útil para determinar las cantidades totales de moléculas que deben juntarse en una reacción para lograr el, o los productos finales sin que sobren moléculas de ninguno de los dos compuestos originales, lo que se conoce como reacción estequeométrica.
Ahora, una molécula es una entidad muy pequeña, y su conteo físico resulta literalmente imposible en la práctica como para establecer la reacción estequeométrica contándolas, ya que cuando se ponen a reaccionar dos sustancias, aunque las cantidades sean pequeñas, el número de moléculas presentes es muy elevado. Por este motivo en lugar de contar las moléculas se usa una unidad mucho mas grande conocida como mol. Un mol de cualquier sustancia tiene siempre una misma cantidad de moléculas 6.023 x 1023 (número de Avogadro), de forma que resultarán iguales en valor, la relación entre los números de moléculas reaccionantes y el número de moles reaccionantes de las sustancias.
El mol queda definido como el peso molecular expresado en gramos, de esta forma un mol de agua, cuyo peso molecular es 18, pesa 18 gramos y a la vez esto significa que 18 gramos de agua tienen 6.023 x 1023 moléculas. Similarmente, el peso molecular del fenobarbital que es 232.2, significa que 232.2 gramos de fenobarbital (un mol) tienen 6.023 x 1023 moléculas.
La utilización del mol como unidad para la determinación de la estequiometría química es sumamente práctica ya que sustituye el impracticable conteo de las moléculas, por una unidad fácilmente medible como peso. Refiriéndonos a las dos reacciones de arriba, se puede decir entonces que un mol de ácido clorhídrico reacciona exactamente (de forma estequeométrica) con un mol de hidróxido de sodio (sosa cáustica), mientras que se necesitan dos moles de la sosa para reaccionar con un mol de ácido sulfúrico.
Equivalente químico
Hay muchas sustancias que al disolverse se disocian en iones, y a las soluciones de estas sustancias se les denomina comúnmenteelectrolitos, así por ejemplo el cloruro de sodio NaCl al disolverse en agua se disocia en los iones Na- y H+ o el ácido sulfúrico H2SO4 que lo hace en los correspondientes (SO4)+2 y 2H-. Cuando se trabaja con este tipo de sustancias, podemos estar interesados solamente en uno de los dos iones del par. Por ejemplo, con los ácidos minerales puede interesarnos solo el número de iones H+ en la solución y no interesarnos el resto de los iones. Por lo tanto no nos importa en realidad la cantidad de gramos o moles de ácido presentes; lo que necesitamos determinar es la cantidad de moles de H+ presentes. El concepto de equivalente químico involucra este tipo de necesidad.El equivalente químico de una sustancia, a veces llamado la fuerza de reacción, es el número de iones univalentes (con valencia 1) necesarios para reaccionar con cada molécula de la sustancia. El ácido clorhídrico tiene equivalente 1 por mol debido a que 1 mol del ion univalente OH- reacciona exactamente con 1 mol de H+ del HCl para formar agua, o un mol de Na+ reaccionaría con el Cl- del ácido clorhídrico para formar cloruro de sodio. Por su parte el ácido sulfúrico (H2SO4) contiene 2 equivalentes por mol porque se requieren 2 moles de OH- para actuar sobre 1 mol de ácido sulfúrico o, de igual, forma se necesitan 2 moles de Na+ para reaccionar exactamente con el ion (SO4)+2.
El compuesto Al2(SO4)3 tiene equivalente 6 porque en solución acuosa se obtienen dos iones Al+3 capaces de reaccionar con 6 iones monovalentes tal como Cl- , o el triple ion sulfato (3SO4-2) también reacciona con 6 iones univalentes como el Cl-.
El término equivalente químico tiene cierta ambigüedad para el caso de electrolitos con iones de valencia variable como los fosfatos o carbonatos, en los cuales la sustancia puede tener diferentes grados de equivalencia en dependencia del pH de la solución. Por ejemplo el Na2HPO4 (fosfato disódico) tiene 2 equivalentes/mol y predomina en soluciones de pH alto, mientras el NaH2PO4 (fosfato monosódico) con equivalente/mol de 1 predomina en las soluciones con pH bajo.
Peso equivalente
El peso equivalente de un elemento o sustancia es aquel peso que se combina químicamente con un equivalente de otro elemento o sustancia. El peso equivalente del HCl es del mismo valor que el peso molecular ya que tiene equivalente 1 por mol y reacciona con un equivalente de otra sustancia. El peso equivalente del ácido sulfúrico es su peso molecular dividido por 2 ya que este ácido tiene un equivalente químico por mol de 2 y por tanto necesita dos equivalentes de la otra sustancia para reaccionar exactamente. El peso equivalente se puede calcular con la expresión general siguiente:P.E. = Peso molecular ó Masa molar / No. Equivalentes por Peso molecular
Tomado de http://www.sabelotodo.org/quimica/equivalente.html
viernes, 26 de abril de 2013
El pH y los electrodos del potenciómetro
Les dejo los 3 videos que vimos sobre los electrodos de pH del potenciómetro.
http://youtu.be/B-UpNyQOzSo
http://youtu.be/GuK_hAmM0BM
http://youtu.be/hYMD5wsQ5Es
http://youtu.be/B-UpNyQOzSo
http://youtu.be/GuK_hAmM0BM
http://youtu.be/hYMD5wsQ5Es
domingo, 14 de abril de 2013
sábado, 13 de abril de 2013
Cálculos para la titulación NaOH vs H2SO4
Los cálculos se hacen en 2 partes.
La 1a parte es para Estandarizar la solución de NaOH que supuestamente está a 0.1 N.
La estandarización de la NaOH se hizo contra Biftalato de Potasio, a través de 3 titulaciones hasta que vire de transparente a rosa con ayuda del indicador fenolftaleína.
Se registraron los 3 volúmenes que se gastaron de la "sosa" NaOH, con los cuales hay que hacer un promedio.
Sabemos que los Equivalentes que reaccionaron de NaOH son los mismos Eq que reaccionaron de Biftalato.
Eq NaOH = Eq Bifta
El lado izquierdo de la ecuación lo podemos escribir como (N)(V), porque Eq = (N)(V)
El lado derecho lo podemos escribir como gr / PE , porque Eq = gr / PE
Estamos expresando los equivalentes de dos formas diferentes, a nuestra conveniencia.
Entonces queda la ecuación: (N)(V) = gr / PE
Aquí lo que estamos buscando es la nueva N de la NaOH. Usamos el V promedio de las 3 titulaciones con fenolftaleína, los gramos que usaron de biftalato (0.51 gr) y el Peso Equivalente del Biftalato (204); y despejamos para la N.
Esa N será la nueva concentración de la NaOH, la real, que será un poco diferente a 0.1 N.
2da Parte: titular la muestra
Ahora con la sosa estandarizada, titulamos 3 veces una muestra de H2SO4 en solución acuosa. La muestra de H2SO4 eran 20 mL de agua más 4 gotas de H2SO4.
Sacamos un V promedio con las últimas 3 titulaciones.
Los Equivalentes que reaccionaron de la sosa son los mismos en cantidad que los Eq que reaccionaron de H2SO4
Eq NaOH = Eq H2SO4
reescribimos la fórmula
(N)(V) = gr / PE
(N)(V) de NaOH = gr / PE de H2SO4
Ahora estamos buscando los gr de H2SO4 en la muestra. Usamos la N estandarizada de la sosa, el V promedio de las últimas 3 titulaciones, y el Peso Equivalente del H2SO4. Ése hay que calcularlo y sale a 49. Despejamos para los gramos.
Cuando se obtengan los gr de H2SO4 se finaliza calculando el % en la muestra.
% H2SO4 = gr H2SO4 / mL muestra x 100
jueves, 11 de abril de 2013
Grupos Funcionales en Química Orgánica
Aquí les dejo esta presentación para que se guíen y reconozcan los grupos funcionales.
Saludos.
Saludos.
viernes, 5 de abril de 2013
Problemas Calcular Entalpía usando Ley de Hess
Aquí les dejo los 3 problemas de tarea del cálculo de entalpía de una reacción a partir de otras reacciones usando la Ley de Hess.
Problema 1
Problema 2
Problema 3
Problema 1
Problema 2
Problema 3
miércoles, 3 de abril de 2013
martes, 2 de abril de 2013
Presentación Química Orgánica - Química II - UVM
Aquí les dejo la presentación de Química Orgánica para que la tengan y la estudien.
Y aquí la versión para descargarla: Presentación Química Orgánica
Saludos.
Y aquí la versión para descargarla: Presentación Química Orgánica
Saludos.
Enlaces Químicos
Aquí les dejo la presentación en la cual podrán estudiar el tema de Enlaces Químicos:
Presentación Enlaces Químicos
Saludos a todos.
Presentación Enlaces Químicos
Saludos a todos.
jueves, 14 de marzo de 2013
Preguntas para película "Crudo"
1. ¿Cuál crees que sea el
motivo por el que Chevron no remedio todos los terrenos contaminados en
Ecuador?
2. ¿Cuál es la técnica que esta usando Chevron para ganar el
caso?
3. ¿Cuál es el interés del abogado gringo de estar apoyando
y orientando a Pablo Fajardo?
4. ¿Qué peligros a la salud existen al estar bebiendo agua
contaminada con hidrocarburos?
5. ¿Qué es un perito?
6. ¿Cómo va a cambiar tu percepción de la industria química
a raíz de la película?
7. ¿Qué responsabilidad debe asumir el jefe de seguridad y
medio ambiente de una industria?
8. ¿Qué perfil debe tener esa persona (que carrera) para
desempeñar su puesto?
sábado, 9 de marzo de 2013
Química I - 2do Parcial UVM
Primeramente les dejo una imagen que describe la historia de los modelos atómicos, por si en el examen les llego a pedir el dibujo de alguno.
Ahora les dejo las dos presentaciones que vimos de la tabla periódica:
Ahora les dejo las dos presentaciones que vimos de la tabla periódica:
viernes, 8 de marzo de 2013
Problemas de Cinética Química / 2do Parcial TSQI UVM
Mis queridos alumnos de Temas Selectos de Química:
Les dejo los 2 problemas para contestar y estudiar para el examen, traen la respuesta. Si tienen dudas me pueden mandar mail, inbox o tweet.
NOTA: Estudien bien la parte de la Energía de Activación, su definición y las 2 gráficas que pusimos de ese concepto.
Saludos.
Les dejo los 2 problemas para contestar y estudiar para el examen, traen la respuesta. Si tienen dudas me pueden mandar mail, inbox o tweet.
NOTA: Estudien bien la parte de la Energía de Activación, su definición y las 2 gráficas que pusimos de ese concepto.
Saludos.
miércoles, 6 de marzo de 2013
domingo, 10 de febrero de 2013
Química II - UVM - 1er Parcial
La estequiometría estudia las relaciones y cantidades correctas
en las que se deben mezclar los reactivos y en las que aparecen los productos
en toda reacción química.
La ley de la conservación de la masa indica que en toda reacción química la masa de los reactivos es igual a la masa de los productos.
La lluvia ácida se origina cuando los gases SO2 y NO2 son emitidos y en la atmósfera reaccionan con el vapor de agua, formando los ácidos sulfúrico y nítrico H2SO4 y HNO3. Estos ácidos caen en precipitaciones tanto en ciudades como bosques, siendo un agua de lluvia corrosiva y que daña la vegetación y las edificaciones humanas.
El efecto invernadero es un fenómeno que origina el calentamiento global. Sucede por la excesiva acumulación de gases como el CO2, emitido por el uso de combustibles, y en menor medida los CFCs, clorofluorocarbonos (sprays, aerosoles y refrigerantes). La radiación solar entra a la atmósfera y "rebota" en la superficie. Sin embargo no sale por completo del planeta ya que estos gases "atrapan" la radiación que ha rebotado, impidiendo que ésta salga. Como resultado el planeta vive un aumento gradual en su temperatura promedio. Los ecosistemas, las corrientes oceánicas y los polos sufren estos cambios.
CONTAMINACIÓN DEL AGUA
Se llama lixiviación al proceso en el cual se genera un desplazamiento de desechos contaminantes por el subsuelo hasta llegar a los ríos, mares y aguas subterráneas.
Los principales contaminantes presentes en el agua son:
Microorganismos patógenos. Virus, bacterias y protozoarios capaces de transmitir enfermedades como el cólera, gastroenteritis, hepatitis, etc.
Desechos orgánicos. Todos los residuos orgánicos generados por el ganado, animales de granja, y el hombre principalmente. Las bacterias los descomponen agotando el oxígeno del agua. Los peces necesitan el oxígeno para vivir.
Químicos inorgánicos. Sales, ácidos, metales pesados como el plomo, mercurio, cadmio, arsénico, etc. Son tóxicos para los seres vivos, corroen materiales y afectan el rendimiento de los cultivos agrícolas.
Químicos orgánicos. petróleo, gasolina, detergentes, plásticos, disolventes, plaguicidas, etc. Permanecen largos periodos en el agua al tener moléculas complejas y ser difícil su biodegradación. Daños múltiples a todo tipo de seres vivos.
Materiales suspendidos, sedimentos. Provocan una turbidez en el agua. En parte es la basura que generamos y en otra parte son partículas arrancadas del suelo.
Contaminación térmica. Las industrias y las centrales de energía liberan agua muy caliente que provoca un desequilibrio en la vida de los seres que habitan el ecosistema acuático local, debido a una disminución en la disolución de oxígeno.
El agua puede ser tratada de distintas maneras. Una filtración por mallas puede eliminar toda la materia suspendida, sedimentos y la basura que contenga. El paso del agua por medios o capas de carbón activado elimina olores, sabores, materia orgánica y algunos solventes orgánicos. Se usan los medios de intercambio iónico para eliminar del agua los metales y muchos contaminantes inorgánicos.
La ley de la conservación de la masa indica que en toda reacción química la masa de los reactivos es igual a la masa de los productos.
El mol es una unidad que equivale a 6.022x1023
átomos o moléculas.
La masa molar representa la masa en gramos de 1 mol de
cualquier elemento o compuesto.
CONTAMINACIÓN DEL AIRE
Los gases contaminantes más comunes en la atmósfera son:
Dióxido de carbono, CO2. Si bien existe naturalmente, su concentración en la atmósfera ha aumentado debido principalmente a la combustión que el hombre mismo ha provocado y necesitado en sus actividades diarias. Toda combustión genera CO2 y mientras más aumente la población, mayores serán los requerimientos de combustibles (petróleo, carbón, gas natural). El CO2 es el principal responsable del Efecto Invernadero.
Monóxido de carbono, CO. Toda combustión que se realice con insuficiencia de oxígeno generará CO. Los automóviles están diseñados para operar al nivel del mar; mientas circulen a mayores alturas la disponibilidad de oxígeno será menor e inevitablemente generarán CO. El monóxido de carbono es un gas letal para el ser humano ya que interfiere en el transporte de oxígeno en la sangre, causando muerte por asfixia. Es inodoro e incoloro, por lo cual es difícil detectarlo.
Monóxido de azufre, SO2. Originado por la combustión de carbón de coque principalmente, y otros combustibles fósiles. Es venenoso, incoloro e irritante para el sistema respiratorio, agravando los síntomas de asma, bronquitis y enfisema pulmonar. Su peligrosidad también radica en que reacciona con el agua de la atmósfera generando ácido sulfúrico, ocasionando la lluvia ácida (primero pasa a trióxido de azufre antes de crear el ácido).
El Índice Metropolitano de la Calidad del Aire, IMECA, funciona como parámetro en nuestro país para medir la contaminación atmosférica. La calidad óptima es entre 1 a 100 IMECAS, mientras que mayor a 100 es No satisfactoria, y de hecho arriba de 200 es Mala, sugiriendo evitar actividades al aire libre.
La lluvia ácida se origina cuando los gases SO2 y NO2 son emitidos y en la atmósfera reaccionan con el vapor de agua, formando los ácidos sulfúrico y nítrico H2SO4 y HNO3. Estos ácidos caen en precipitaciones tanto en ciudades como bosques, siendo un agua de lluvia corrosiva y que daña la vegetación y las edificaciones humanas.
El efecto invernadero es un fenómeno que origina el calentamiento global. Sucede por la excesiva acumulación de gases como el CO2, emitido por el uso de combustibles, y en menor medida los CFCs, clorofluorocarbonos (sprays, aerosoles y refrigerantes). La radiación solar entra a la atmósfera y "rebota" en la superficie. Sin embargo no sale por completo del planeta ya que estos gases "atrapan" la radiación que ha rebotado, impidiendo que ésta salga. Como resultado el planeta vive un aumento gradual en su temperatura promedio. Los ecosistemas, las corrientes oceánicas y los polos sufren estos cambios.
CONTAMINACIÓN DEL AGUA
Se llama lixiviación al proceso en el cual se genera un desplazamiento de desechos contaminantes por el subsuelo hasta llegar a los ríos, mares y aguas subterráneas.
Los principales contaminantes presentes en el agua son:
Microorganismos patógenos. Virus, bacterias y protozoarios capaces de transmitir enfermedades como el cólera, gastroenteritis, hepatitis, etc.
Desechos orgánicos. Todos los residuos orgánicos generados por el ganado, animales de granja, y el hombre principalmente. Las bacterias los descomponen agotando el oxígeno del agua. Los peces necesitan el oxígeno para vivir.
Químicos inorgánicos. Sales, ácidos, metales pesados como el plomo, mercurio, cadmio, arsénico, etc. Son tóxicos para los seres vivos, corroen materiales y afectan el rendimiento de los cultivos agrícolas.
Químicos orgánicos. petróleo, gasolina, detergentes, plásticos, disolventes, plaguicidas, etc. Permanecen largos periodos en el agua al tener moléculas complejas y ser difícil su biodegradación. Daños múltiples a todo tipo de seres vivos.
Materiales suspendidos, sedimentos. Provocan una turbidez en el agua. En parte es la basura que generamos y en otra parte son partículas arrancadas del suelo.
Contaminación térmica. Las industrias y las centrales de energía liberan agua muy caliente que provoca un desequilibrio en la vida de los seres que habitan el ecosistema acuático local, debido a una disminución en la disolución de oxígeno.
El agua puede ser tratada de distintas maneras. Una filtración por mallas puede eliminar toda la materia suspendida, sedimentos y la basura que contenga. El paso del agua por medios o capas de carbón activado elimina olores, sabores, materia orgánica y algunos solventes orgánicos. Se usan los medios de intercambio iónico para eliminar del agua los metales y muchos contaminantes inorgánicos.
viernes, 8 de febrero de 2013
Líquidos y Gases
El modelo cinético molecular se basa en que los átomos y moléculas en movimiento chocan sin perder su energía cinética, lo cual constituye un choque elástico. En base a este principio y a la idea de que las partículas están en movimiento, podemos describir a los líquidos y a los sólidos de la siguiente manera:
Características de los líquidos
Las fuerzas que los mantienen unidos son llamadas fuerzas intermoleculares. Se dividen en:
Los sólidos covalentes son más duros por sus uniones covalentes. Sus puntos de fusión son elevados. Ejemplo de ellos son el diamante.
Características de los líquidos
Las fuerzas que los mantienen unidos son llamadas fuerzas intermoleculares. Se dividen en:
- Fuerzas ion-dipolo: Se presentan entre iones y moléculas, pero sólo moléculas polares, de manera que el polo positivo de la molécula sea atraído por un anión, y que el polo negativo de la molécula atraiga un catión.
- Fuerzas dipolo-dipolo: Se presentan entre dos moléculas polares, de manera que el lado positivo de la molécula se une al lado negativo de otra molécula igual (o incluso diferente).
- Fuerzas de London: Son muy débiles, se presentan entre moléculas no polares. Al no ser polares las moléculas la única explicación de que se sientan atraídas es que momentáneamente los electrones se ubiquen en un extremo de la molécula dándole una polaridad provisional y fugaz.
- Puentes de Hidrógeno: Se dan entre el Hidrógeno con cualquier elemento muy electronegativo, como el O, N, F.
La presión de vapor de un líquido indica la capacidad de que ese líquido se convierta en vapor a una misma temperatura. Si la presión de vapor de un líquido iguala a la presión de la atmósfera, el líquido comenzará a hervir o ebullir. Cada líquido tiene su presión de vapor propia, a una misma temperatura; si comparamos dos presiones de vapor de dos líquidos, la mayor corresponde al líquido más volátil.
Si dejamos caer sobre una mesa una gota de agua y otra de acetona, se evaporará primero la acetona, antes que el agua. Esto obedece que para esa temperatura ambiente, la presión de vapor de la acetona es mayor que la del agua.
El punto de ebullición es una propiedad muy relacionada con la presión de vapor. Indica la temperatura a la que un líquido ebullirá o hervirá, considerando que la presión permanece constante. Para el ejemplo de la acetona y el agua, el líquido que tenga el punto de ebullición menor será el más volátil.
La tensión superficial es la propiedad de un líquido de crear una capa en su superficie, resistente a romperse hasta cierto peso, propiciado porque las moléculas se atraen en el plano horizontal, en todo el borde de la superficie del líquido. Esta atracción es mayor a la de las moléculas que están en el interior del líquido.
La capilaridad es la propiedad que hace que un líquido ascienda por un conducto de diámetro pequeño. Tiene relación con la tensión superficial.
Con el ejemplo del menisco podemos describir las fuerzas de cohesión, que son mayores en un tubo de ensayo con mercurio que en un tubo con agua. En cambio en ese mismo ejemplo vemos que en el agua son mayores las fuerzas de adhesión que en el mercurio. Esto lo notamos por la forma del menisco de cada uno en el tubo de ensayo.
Características de los sólidos
Los sólidos amorfos son aquellos en los cuales sus moléculas no presentan ningún tipo lógico de ordenamiento.
Los sólidos cristalinos presentan una estructura cristalina de sus moléculas, ordenada y bien definida; generalmente formada por un patrón llamado celda unitaria, que es el más pequeño patrón identificable que se puede repetir en toda la estructura del sólido.
Los sólidos moleculares son aquellos que se unen con fuerzas intermoleculares, parecidas a las de los líquidos, en donde no se tiene mucha fuerza entre sus enlaces. Son blandos y sus puntos de fusión son bajos. Ejemplos de ellos son el hielo seco, el fósforo y el agua congelada.
Los sólidos covalentes son más duros por sus uniones covalentes. Sus puntos de fusión son elevados. Ejemplo de ellos son el diamante.
Los sólidos iónicos se crean a partir de las uniones de cationes y aniones, por lo que su estructura es cristalina y dependerá de las cargas de los iones y de sus radios. Siguen siendo fuertes.
Los sólidos metálicos son aquellos de los metales puros, cada arista, esquina, punto de la estructura es un átomo del metal. Los electrones se distribuyen en todo el sólido y esto los hace excelentes conductores del calor y la electricidad.
Suscribirse a:
Entradas (Atom)